Roestvast staal is sterk en roestbestendig, maar kan onder bepaalde omstandigheden toch falen. Elektrolytische corrosie verrast ingenieurs en fabrikanten vaak wanneer roestvast staal zijn sterkte verliest. Het probleem verergert in ruwe omgevingen, waar zwakke plekken ontstaan en de prestaties afnemen. Deze zwakke plekken kunnen ook de levensduur van onderdelen verkorten.
Ingenieurs moeten de wetenschap achter elektrolytische corrosie begrijpen. Ze moeten weten wat het veroorzaakt, hoe het te voorkomen en hoe het te repareren. Deze kennis helpt hen betere keuzes te maken bij het ontwerpen en gebruiken van roestvast staal.

Wat is elektrolytische corrosie van roestvrij staal?
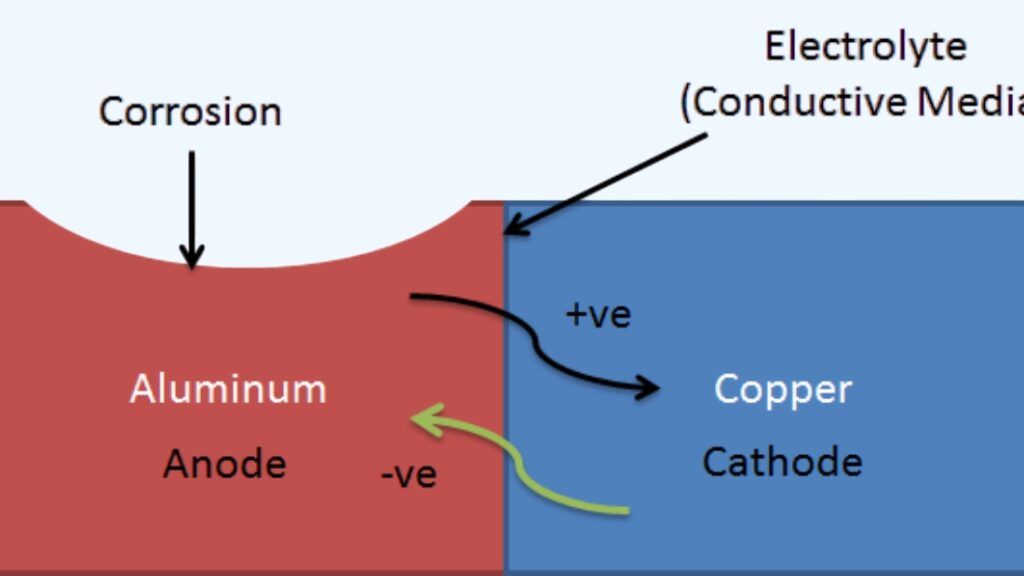
Elektrolytische corrosie treedt op wanneer roestvast staal afbreekt onder invloed van elektrische stroom in een natte of geleidende omgeving. De stroom kan afkomstig zijn van contact met andere metalen, zwerfelektriciteit of geladen deeltjes in de omgeving. Wanneer dit gebeurt, bewegen elektronen tussen verschillende gebieden op het metaal, waardoor een anode en een kathode ontstaan. De anode verliest materiaal, wat zichtbaar is als putjes, barsten of een dunner oppervlak.
Dit proces is niet hetzelfde als normaal roesten. Roesten kan gebeuren in lucht en vocht, maar elektrolytische corrosie heeft een elektrisch pad nodig. Roestvast staal dat jarenlang sterk blijft in droge lucht, kan veel sneller kapot gaan wanneer het wordt blootgesteld aan water, zouten of zwervende elektrische stromen.
Grondbeginselen van elektrolytische corrosie
Elektrolytische corrosie werkt ongeveer zoals een eenvoudige batterij. Het heeft een metalen oppervlak, een elektrolyt en een pad voor elektrische stroom nodig. Wanneer deze drie aanwezig zijn, verschuift het materiaal van de ene plek naar de andere. Dit proces volgt duidelijke regels, maar in roestvrij staal leidt het vaak tot plotselinge defecten als de omstandigheden niet onder controle zijn.
Corrosie ontstaat door elektrochemische reacties. Roestvrij staal heeft plekken die fungeren als anode en andere die fungeren als kathode. Aan de anode verliezen metaalatomen elektronen en veranderen in ionen die oplossen in de elektrolyt. Aan de kathode worden elektronen verbruikt door reacties zoals zuurstofreductie.
Onder normale omstandigheden beschermt de chroomoxidelaag op roestvrij staal tegen deze reacties. Maar als die laag beschadigd raakt of als er een elektrische stroom door het oppervlak loopt, valt de bescherming weg. De blootgestelde delen beginnen te putten, barsten of slijten weg. Als deze schade eenmaal begint, breidt ze zich vaak uit omdat de zwakke plekken minder bescherming hebben dan de rest van het oppervlak.
Rol van elektrolyten en geleidende paden
Elektrolytische corrosie heeft een elektrolyt nodig om te beginnen. Vocht met zouten, chloriden of andere geladen deeltjes vormt een geleidende oplossing die stroom laat lopen. Voorbeelden zijn zeewater, schoonmaakoplossingen of condensatie met deeltjes uit de lucht. Hoe hoger het ionenniveau, hoe sneller de corrosie zich verplaatst.
Er is ook een geleidend pad nodig om het circuit te voltooien. Dit kan ontstaan wanneer roestvast staal een ander metaal raakt of wanneer elektrische zwerfstromen door een constructie lopen. Lassen, bevestigingsmiddelen en verbindingen van gemengde metalen zijn vaak zwakke punten. Als het pad eenmaal bestaat, wordt het roestvast staal onderdeel van een elektrochemische cel en gaat de corrosie sneller.
Verschil tussen algemene corrosie en elektrolytische corrosie
Algemene corrosie verspreidt zich gelijkmatig over een oppervlak. Het wordt vaak zichtbaar als gelijkmatige verdunning of verkleuring. Dit type is gemakkelijker te voorspellen en te beheersen omdat coatings of betere materiaalkeuzes het kunnen vertragen.
Elektrolytische corrosie is anders. Het is plaatselijk, gericht en vaak agressiever. Het kan diepe putten of scheuren veroorzaken terwijl het grootste deel van het oppervlak onaangeroerd blijft. Omdat het ongelijkmatig is, is het moeilijker om het vroeg op te merken. Een onderdeel kan er aan de buitenkant goed uitzien, maar binnenin ernstig verzwakt zijn.
Oorzaken van elektrolytische corrosie roestvrij staal
Elektrolytische corrosie gebeurt niet willekeurig. Het treedt op wanneer onder bepaalde omstandigheden stroom kan vloeien en metaal kan verwijderen. Deze omstandigheden zijn vaak het gevolg van ontwerpkeuzes, de werkomgeving of externe elektrische factoren.
Galvanische koppeling met ongelijke metalen
Wanneer roestvast staal in contact komt met een ander metaal in de aanwezigheid van een elektrolyt, vormt zich een galvanische cel omdat de twee metalen verschillende elektrische potentiëlen hebben; het ene metaal fungeert als de anode en corrodeert sneller, terwijl het andere metaal fungeert als de kathode en beschermd wordt.
Er ontstaat bijvoorbeeld een aanzienlijk potentiaalverschil als roestvast staal wordt bevestigd met koolstofstalen bouten in een vochtige omgeving. Het zwakkere metaal corrodeert het eerst, maar het roestvast staal kan ook plaatselijke schade oplopen in de buurt van de contactpunten.
Zwerfstromen in elektrische systemen
Zwervende elektrische stromen zijn een andere belangrijke oorzaak. Deze stromen zijn vaak afkomstig van slechte aarding, nabijgelegen apparatuur of elektrische railsystemen. Wanneer er stroom door roestvrij staal loopt, beschadigt dit de passieve laag en versnelt het de corrosie.
In tegenstelling tot galvanische corrosie, waarvoor twee metalen nodig zijn, kan zwerfstroomcorrosie roestvast staal aantasten. Lassen, verbindingen en spanningsgebieden gaan meestal het eerst stuk omdat de stroom zich op die plekken concentreert.
Omgevingsfactoren
Vocht zorgt voor het geleidende pad dat nodig is voor elektrolytische corrosie. Wanneer zouten of zuren aanwezig zijn, verloopt de reactie sneller. Chloride-ionen zijn bijzonder agressief en kunnen gemakkelijk door de beschermende laag breken.
Maritieme omgevingen, chemische fabrieken en voedselverwerkende fabrieken creëren vaak deze omstandigheden. Roestvast staal dat wordt blootgesteld aan zeewater, reinigingsoplossingen of zure chemicaliën verliest snel aan weerstand. Hoe langer de blootstelling, hoe dieper en schadelijker de corrosie wordt.
Mechanische spanning en oppervlakteschade
Mechanische belasting maakt roestvast staal gevoeliger voor aantasting. Processen zoals buigen, lassen of machinaal bewerken kunnen de beschermende laag uitrekken of verstoren, waardoor kale plekken open komen te staan voor corrosie.
Oppervlaktebeschadiging door krassen, deuken of slechte afwerking creëert ook aanknopingspunten voor corrosie. Zodra de film breekt, begint de elektrolytische werking gemakkelijker, vooral wanneer er vocht of zwerfstromen aanwezig zijn.
Hoe elektrolytische corrosie herkennen?
Elektrolytische corrosie kan in een vroeg stadium moeilijk op te sporen zijn. Het verspreidt zich niet altijd gelijkmatig en het oppervlak kan er prima uitzien terwijl er zich eronder schade ontwikkelt. Ingenieurs en onderhoudsteams moeten de waarschuwingssignalen vroegtijdig opmerken om storingen te voorkomen.
Een veelvoorkomend teken is plaatselijke putjes, die te zien zijn als kleine gaatjes of holtes in het metaal. Deze putjes kunnen zich in clusters vormen en na verloop van tijd dieper worden. Een ander waarschuwingssignaal is verkleuring. Dit kan eruit zien als donkere vlekken, strepen of ongelijke plekken waar de beschermende laag is afgebroken.
Scheurtjes of dunner wordende delen die onder spanning staan, zoals lasnaden of bochten, zijn ook sterke indicatoren. In sommige gevallen kunnen onderdelen verzwakken zonder duidelijke veranderingen aan het oppervlak. Er worden testmethoden gebruikt om deze verborgen schade op te sporen. Deze omvatten elektrische weerstandscontroles, potentiaalmetingen en niet-destructieve inspecties, zoals ultrasone testen.

Preventiestrategieën
Het voorkomen van elektrolytische corrosie in roestvast staal begint met een goede planning. De juiste materialen kiezen, zorgvuldig ontwerpen en oppervlakken beschermen helpen allemaal om de risico's te verlagen en de levensduur te verlengen.
Juiste materiaalselectie en legering
Het gebruik van roestvast staal met een hoger gehalte aan chroom, nikkel of molybdeen verbetert de weerstand. Door metalen te kiezen die compatibel zijn in gemengde assemblages worden galvanische reacties voorkomen. In ruwe omgevingen bieden duplex- of marine-legeringen een langere duurzaamheid.
Beschermende coatings en oppervlaktebehandelingen
Coatings en behandelingen voegen een barrière toe tussen roestvrij staal en de omgeving. Opties zijn onder andere epoxyverf, corrosiebestendige films of passiveringsbehandelingen die de chroomoxidelaag versterken. Regelmatige controles en onderhoud zorgen ervoor dat deze beschermingen effectief blijven.
Ontwerpoverwegingen om corrosierisico's te beperken
Een goed ontwerp helpt voorkomen dat corrosie begint. Vermijd scherpe hoeken, krappe spleten en ruwe lasnaden waar vocht zich kan ophopen. Zorg voor een goede afwatering en houd ruimte tussen ongelijke metalen om galvanisch contact te verminderen.
Elektrische isolatie en kathodische bescherming
Door roestvrij staal van andere metalen te scheiden met niet-geleidende materialen wordt galvanische corrosie tegengegaan. In omgevingen met een hoog risico kunnen opofferingsanoden of kathodische beschermingssystemen elektrische zwerfstromen afvoeren. Deze aanpak vermindert materiaalverlies en verlengt de levensduur.
Praktische oplossingen voor bestaande corrosie
Als elektrolytische corrosie eenmaal begint, is snelle actie essentieel om te voorkomen dat de corrosie zich uitbreidt en om de prestaties te herstellen. De juiste oplossing hangt af van hoe diep de schade is en hoe kritisch het onderdeel in gebruik is.
Mechanische reiniging is vaak de eerste stap. Slijpen, polijstenof stralen kan oppervlaktecorrosie verwijderen en een schone ondergrond creëren. Na het reinigen, passiveringsbehandelingen helpen de beschermende chroomoxidelaag opnieuw op te bouwen, waardoor het oppervlak beter bestand is.
Voor meer bodemloze putjes of scheuren kan reparatielassen nodig zijn. Het gebruik van de juiste toevoegmaterialen en de juiste nabehandelingen voorkomen dat zich nieuwe corrosie vormt. Het vervangen van de sectie kan de enige veilige optie zijn als de schade te ernstig is, vooral als de sterkte is aangetast.
Beschermende coatings zijn een andere praktische methode. Verf, epoxylagen of membraancorrosiebestendige folies vormen een barrière tussen roestvast staal en zijn omgeving. Elektrische isolatie kan ook galvanische werking voorkomen wanneer roestvast staal zich in de buurt van andere metalen bevindt.
Wanneer zwerfstromen het probleem veroorzaken, kan het repareren van aardingssystemen of het toevoegen van opofferingsanoden de elektriciteitsstroom wegleiden van het stalen oppervlak. Regelmatige inspecties en doorlopend onderhoud zijn essentieel om reparaties effectief te houden en de levensduur van het onderdeel te verlengen.
Conclusie
Elektrolytische corrosie in roestvast staal ontstaat wanneer elektrische stromen, vocht en geleidende paden de beschermende chroomoxidelaag afbreken. Het begint vaak op plaatsen waar roestvast staal in contact komt met andere metalen, mechanische spanning ondervindt of in contact komt met zouten en zuren. Preventie vereist verstandige materiaalkeuzes, een zorgvuldig ontwerp, beschermende coatings en routinematig onderhoud.
Als je je roestvrijstalen onderdelen veilig wilt houden of oplossingen nodig hebt voor bestaande corrosie, neem vandaag nog contact op met ons team voor deskundige begeleiding en betrouwbare ondersteuning voor uw projecten.
Hey, ik ben Kevin Lee

De afgelopen 10 jaar heb ik me verdiept in verschillende vormen van plaatbewerking en ik deel hier de coole inzichten die ik heb opgedaan in verschillende werkplaatsen.
Neem contact op

Kevin Lee
Ik heb meer dan tien jaar professionele ervaring in plaatbewerking, gespecialiseerd in lasersnijden, buigen, lassen en oppervlaktebehandelingstechnieken. Als technisch directeur bij Shengen zet ik me in om complexe productie-uitdagingen op te lossen en innovatie en kwaliteit in elk project te stimuleren.